Gobierno de la ciudad de Buenos Aires
Hospital Neuropsiquiátrico
"Dr. José Tiburcio Borda"
Laboratorio de Investigaciones Electroneurobiológicas
y
Revista
Electroneurobiología
ISSN: ONLINE 1850-1826 - PRINT 0328-0446

Desarrollo del modelo matemático de Hodgkin y Huxley en neurociencias
por
Pedro W. Lamberti
Facultad de
Matemática, Astronomía y Física, Universidad Nacional de Córdoba – CONICET,
lamberti@famaf.unc.edu.ar
y
Víctor Rodríguez
Facultad de Filosofía y Humanidades,
Universidad Nacional de Córdoba; rovic@arnet.com.ar
Ciudad Universitaria (5000), Córdoba, República Argentina
Electroneurobiología 2007;
15 (4), pp. 31-60; URL http://electroneubio.secyt.gov.ar/index2.htm
Copyright © September 2007 Electroneurobiología. Diese Forschungsarbeit ist öffentlich zugänglich. Die treue
Reproduktion und die Verbreitung durch Medien ist nur unter folgenden Bedingungen
gestattet: Wiedergabe dieses Absatzes sowie Angabe der kompletten Referenz bei
Veröffentlichung, inklusive der originalen Internetadresse (URL, siehe oben). /
Este texto es un artículo de acceso público; su copia exacta y redistribución
por cualquier medio están permitidas bajo la condición de conservar esta
noticia y la referencia completa a su publicación incluyendo la URL (ver
arriba). / This is an Open Access article: verbatim copying and redistribution
of this article are permitted in all media for any purpose, provided this
notice is preserved along with the article's full citation and URL (above).
Accepted and published: September 28, 2007
Puede obtener un archivo .PDF (recomendado: 1,4 MB) o .DOC (1,1 MB) para leer o imprimir este artículo, desde aquí o de
/ You can download a .PDF (recommended: 1.4 MB) or .DOC (1.1 MB) file for reading or printing, either from here or
http://electroneubio.secyt.gov.ar/index2.htm

ABSTRACT: On research
work started in the 1930s, with a gap imposed by the Second World War, English
physiologists and biophysicists Alan Lloyd Hodgkin (1914-1998) and Andrew Fielding
Huxley (born 1917) achieved in the early 1950s one of the most successful and
representative mathematical models in neuroscience. Of this key conceptual tool
in neurobiology, a brief historical-technical exposé is offered hereby. We underscore
its mathematical structure (a coupled non lineal partial differential equation
system, depending on space and time) as well as the development of its
influence as a respected model of current biophysics. By integrating this
equation system, those authors succeeded to describe the generation and propagation
of the action potential in the squid's giant axon, explaining its main
features, too. The import of these researches in the development of neuroscience
in the latter half of the twentieth century is of great consequence. [Article in Spanish]
RESUMEN: A partir de trabajos comenzados en la década de
1930, tras un intervalo impuesto por la Segunda Guerra Mundial, los fisiólogos
y biofísicos británicos Alan Lloyd Hodgkin (1914-1998) y Andrew Fielding Huxley
(nacido en 1917) concluyeron a comienzos de la década de 1950 uno de los modelos
matemáticos más exitosos y representativos de las neurociencias. Se ofrece una
breve exposición histórico-técnica de este valioso instrumento conceptual
neurobiológico. Señalamos su estructura (un sistema de ecuaciones diferenciales
en derivadas parciales, acopladas, no lineales, dependientes del espacio y del
tiempo) así como el desarrollo de su influencia como modelo vigente en la
biofísica actual. Con la integración de este sistema de ecuaciones, dichos
autores lograron describir la generación y propagación del potencial de acción
en el axón gigante de calamar, como así también explicar sus principales
propiedades. La importancia de estos trabajos en el desarrollo de las neurociencias
de la segunda mitad del Siglo XX es realmente significativa.

Introducción
Existen
antecedentes importantes en lo referido a la investigación de las relaciones
entre fenómenos electromagnéticos y biológicos, que no serán objeto de la
presente reseña. Muchos de esos antecedentes se remontan a los siglos XVIII,
XIX y comienzos del XX. Pese al gran valor para la ciencia que tuvieron en su
día, los afectaban graves imprecisiones. Serias limitaciones, de orden teórico
y experimental, impedían un conocimiento adecuado de los procesos involucrados;
en particular, en lo atinente a la transmisión de la excitación nerviosa.
Como marco
general, cabe apuntar que el desarrollo de mejores técnicas experimentales
permitió establecer, de una manera directa, la relación existente entre los
fenómenos eléctricos observados en los seres vivos y su estructura celular. En
particular fue posible verificar experimentalmente, en todas las células de
todos los organismos vivos, una diferencia de potencial eléctrico a través de
la membrana. Este "potencial", que en términos operativos es siempre
una diferencia de potencial entre dos puntos, o voltaje,
se conoce como potencial de reposo. Existe también en las células que no son excitables eléctricamente,
aunque en esta sinopsis sólo nos ocuparemos de las que sí lo son. Fuera y dentro
de las células hay cierto número de cargas eléctricas disueltas, capaces pues
de ser movidas. Se las llama iones,
que significa "los andantes". Son átomos disueltos, de sodio,
potasio, calcio, cloro …, cuya carga eléctrica dejó de estar equilibrada en una
combinación molecular. Aquel potencial, que en el interior de la célula (citoplasma) es negativo respecto al
exterior, lo forma la diferencia de concentración, entre el interior y el exterior
de la célula, de esas cargas eléctricas disueltas (iones). Debido a la
repulsión electrostática, cada una de
estas cargas "andantes" emprende cierto movimiento como efecto de los
cambios, en la distribución espacial de los valores del campo eléctrico,
generados por el cambio de las concentraciones o distribución espacial de todos
esos iones: cada una se mueve en reacción
al cambio en la distribución de todas
las demás. Mientras esta distribución se mantiene, aquel potencial sigue en
reposo. Por eso, el potencial se mantiene mientras los iones no pueden salir de
la célula ni entrar a ella. Cuando entran o salen, su concentración relativa
varía y la magnitud del potencial de
reposo se altera. Puede formar un potencial
de acción.
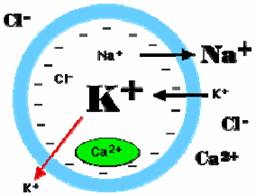
Tengamos presente
que fuera de la célula la concentración del ión sodio, Na+, es una diez veces mayor que en
el interior; y que la concentración del ión potasio, K+, disuelto fuera de la célula es
unas veinte veces mayor que en el interior. La
concentración de los iones cloro (Cl-) y calcio (Ca2+)
también se mantiene más alta afuera que adentro, con la excepción de que algunas
concentraciones en compartimientos intracelulares englobados por membrana
(óvalo verde, en la figura) pueden contener una alta concentración del ión
calcio (Ca2+). Esta configuración de cargas iónicas se mantiene por medio de un
"motorcito", llamado bomba sodio/potasio. Tras una cadena de reacciones
químicas que le permite consumir energía de moléculas de ATP, el "motorcito"
bombea hacia adentro sólo dos iones potasio, K+, por cada tres iones sodio, Na+, que bombea hacia fuera. La bomba sodio/potasio hace perder cargas
positivas al interior de la célula: negativiza el interior. A esto se suma que
algunos canales para el paso del potasio a través de la membrana “tienen pérdidas".
Eso permite una suplementaria difusión facilitada del ión potasio, K+, hacia el exterior (flecha roja, en la figura)
El registro del
potencial resultante, en la escala espacial de micrones, de esa cambiante
configuración de las cargas iónicas en escala aun mucho más minúscula, se logra
por medio de dos electrodos. Sus cables de conexión permiten comparar en un
sitio los valores de dos puntos, como es usual para medir cualquier voltaje. Un
electrodo se pone en contacto con el citoplasma, mientras el otro se mantiene
inmerso en el medio extracelular. Para células grandes, tales como el axón
gigante de calamar del Atlántico Loligo pealei (0,5 a 1
mm de diámetro, es decir 500 a 1000 mm), se usa un tubo capilar de
vidrio de unos 100 mm de diámetro.
De manera casi universal [Fisher Weiss, 1997] se observa en las células
investigadas que el potencial eléctrico (Vm0 ) del
citoplasma tiene una magnitud, negativa respecto al medio extracelular, en el
rango –100 mV £ Vm0
£ -10 mV.
Ciertas células
en los organismos vivos (células nerviosas, musculares, etc.) son eléctricamente
excitables. Su excitación o sacudida (ébranlement, nombre francés
bastante utilizado en el siglo XIX) consiste en un potencial
de acción, a veces llamado impulso eléctrico. Este es una variación brusca
del potencial de reposo. Está formada por una onda de descarga eléctrica que,
mientras se va realizando, ocupa en la membrana de la célula sólo una zona
restringida, la cual se desliza o propaga por la superficie que aún queda libre
en la misma célula, la que usualmente es de forma alargada.
Estas sacudidas, excitaciones o potenciales de acción son
eventos localizados en tiempo y espacio. Sirven pues para llevar información entre
unos tejidos y otros, lo que los hace eventos cuasi-microscópicos necesarios
para la vida de los organismos de tamaño macroscópico. Las excitaciones pueden
generarse en diversas clases de células, pero las más activas en su uso son las
células del sistema nervioso. Al producir excitaciones oportunamente y en sitios
apropiados, desde donde empiezan a propagarse, estas células nerviosas se
envían mensajes entre sí o los envían a otros tejidos corporales, por ejemplo
músculos que así se contraen o glándulas que así varían adecuadamente su
función secretora. Muchas plantas también generan potenciales de acción, que viajan a
través de su floema para coordinar la actividad; asimismo lo hacen organismos
macroscópicos de otros reinos vivos. Las excitaciones o sacudidas eléctricas naturales son
siempre típicas o estándar para cada tipo de tejido, cuya estructura establece
sus características.
En el laboratorio
tales ébranlements o sacudidas pueden inducirse también por contacto
eléctrico. Cuando se hace pasar una corriente de origen artificial e intensidad
suficiente a través de la membrana de una célula viva eléctricamente excitable,
se genera en el potencial de reposo de ésta un cambio localizado, siempre de
características estándar, que se propaga constituyendo un típico potencial de
acción.
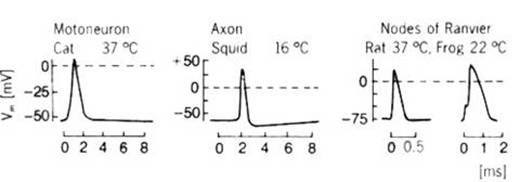
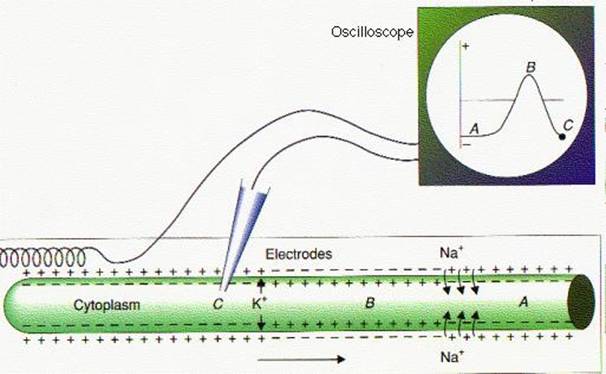
El primer registro
directo del curso detallado de un potencial de acción [Hodgkin y Huxley, 1939]
lo lograron Alan Lloyd Hodgkin (1914-1998, foto izq. en pág. 8) y Andrew
Fielding Huxley (nacido en 1917, der.) en 1939.
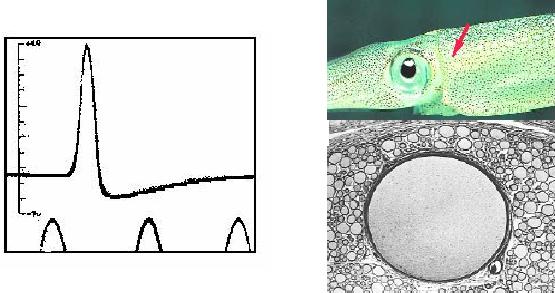
Registro histórico de un potencial de acción en
el axón gigante de calamar logrado por Hodgkin y Huxley en 1939. Tomado de Nature (1939) 144, pág. 710. En el calamar,
este axón se prolonga caudalmente, pasando por donde indica la flecha de color.
Al corte, se lo ve rodeado de otros axones paralelos, de diámetro normal.
Luego los mismos
científicos, tras largo esfuerzo, lograron desarrollar un modelo matemático
“ideal” cuyo comportamiento, al variarle los valores de diversos factores
integrantes, resulta bastante paralelo al comportamiento del hecho natural
observado en el laboratorio. Ese acuerdo entre los comportamientos repetibles
del hecho observado y del modelo ideal, evidenciaron la validez del mismo.

Entre las
propiedades fundamentales del potencial de acción, que el modelo pudo
describir, se destacan las siguientes:
Ø
Existe un umbral (bien
marcado, del orden del 0,1% en la amplitud de la corriente) por superarse para
producir un potencial de acción.
Ø
Existe un período refractario,
esto es, no se puede producir un segundo potencial de acción demasiado pronto,
tras la ocurrencia de un potencial de acción.
Ø
El potencial de acción se regenera
al propagarse. En células excitables, la excitación generada en cierta
región de la membrana celular puede abrirse camino a lo largo de la célula, a
grandes distancias (decímetros y también metros, en animales muy grandes) sin distorsión
ni reducción. La velocidad de propagación propia del impulso en el axón gigante
es cercana a los 21 ms-1, mientras que en los vertebrados, en una
fibra nerviosa recubierta de mielina,
llega hasta ~120 ms-1 (~430 km/h).
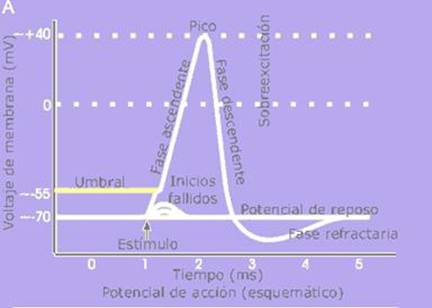
Vista esquemática de un potencial de
acción ideal, mostrando sus distintas fases.
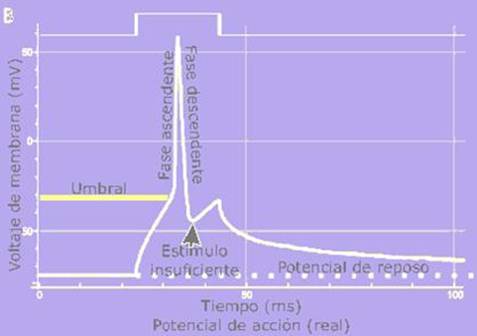
Registro real de un potencial de
acción, normalmente deformado, comparado con el esquema debido a las técnicas
electrofisiológicas utilizadas en la medición.
El logro de una
descripción satisfactoria para el potencial de acción dependió del desarrollo
de sofisticadas técnicas experimentales, minuciosas mediciones y, finalmente,
el desarrollo de un complejo modelo basado en física y matemáticas. La primera
versión de este modelo se conoce como HH. Ha conocido refinamientos ulteriores,
para algunos de los cuales se propusieron los nombres de sus respectivos
autores, mientras otros se conocen como modelos de tipo HH.
El presente
trabajo está dedicado a realizar una breve exposición histórico-técnica del modelo
original, tanto en su génesis, por tratarse de un proceso de ricos matices
históricos para las neurociencias, como bocetando algunas de sus proyecciones
en las décadas siguientes.
Algunos antecedentes histórico-técnicos
El
establecimiento con criterio moderno de la relación entre lo que actualmente se
conoce como neurofisiología y los fenómenos eléctricos no biológicos se remonta
a tiempos de Luigi Galvani. En 1791 este investigador italiano propuso la
existencia de una "electricidad animal", tras verificar el efecto que
la descarga eléctrica tenía sobre los músculos de un animal muerto. Poco
después, Alessandro Volta demostró que esta "electricidad animal" no
era distinta de la electricidad observada en otros fenómenos eléctricos. El
físico italiano Carlo Matteucci realizó en 1842 las primeras mediciones del
potencial de reposo [Matteucci, 1842, 1844].
En 1843, Emil
Heinrich du Bois-Reymond verificó que el sistema nervioso utilizaba electricidad
para comunicar distintas partes del cuerpo [du Bois-Reymond, 1843]. Esencialmente
realizó el mismo experimento que Galvani, pero con organismos vivos. Poco después,
Rudolph von Kölliker encontró que las fibras electrificadas por du Bois-Reymond
eran extensiones de células nerviosas. En 1852 Hermann von Helmholtz, físico y
fisiólogo teutón de veintiueve años de edad, determinó la velocidad de
propagación del impulso nervioso en una célula nerviosa de rana [Helmholtz,
1852]. Pero el hecho, de que esta velocidad fuese sustancialmente menor que
aquella que se había medido para la electricidad en un cable conductor, trajo
nuevas dudas sobre el carácter eléctrico de los impulsos nerviosos.
Es interesante
rescatar del propio H. Von Helmholtz la concepción del sistema nervioso como un
tendido de cables telegráficos, concepción académicamente prevalente para fines
del siglo XIX [Helmholtz, 1889]:
Las fibras nerviosas han sido frecuentemente
comparadas con cables telegráficos que atraviesan un país. La comparación es
adecuada para ilustrar lo interesante y peculiar de su modo de funcionamiento.
En las redes de telégrafos encontramos en todos lados los mismos cables de
cobre que portan la misma clase de movimiento, una estela de electricidad, pero
produciendo los más diversos resultados en las distintas estaciones de acuerdo
a los aparatos auxiliares a los que ellos están conectados. En una estación el
efecto es el sonido de una campana, en otra una señal se mueve, en una tercera
un registrador se pone a funcionar... Toda la diferencia que se observa en la
excitación de distintos nervios depende solo de la diferencia de los órganos a
los cuales el nervio está unido y a los cuales transmite el estado de excitación.
En 1888, en el
ámbito de la físico-química, se logró un adelanto conceptual que posteriormente
tuvo marcada influencia en la neurofisiología. Se trata del trabajo en que
Walter Nernst formuló una ecuación [Nernst, 1888] para describir el equilibrio
difusivo de partículas cargadas. En el contexto que nos interesa actualmente,
bastará recordar que el potencial de equilibrio de Nernst está dado por la
expresión:
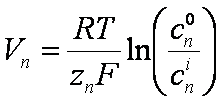
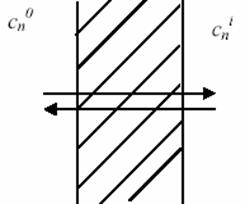
Derecha:
esquema
del medio intra y extracelular
donde cn0
y cni son las concentraciones del ión de tipo n,
a uno y otro lado de la membrana, zn su valencia, F la
constante de Faraday, R la constante de los gases y T la
temperatura absoluta de la solución (ver figura). A temperatura ambiente, el factor
que precede al logaritmo resulta del orden de 25 mV para el potasio.
Entre 1900 y
1950, la concepción dominante, tanto para el potencial de reposo como para el
potencial de acción, era la teoría propuesta en 1902 por Julius Bernstein
(1839-1917). De acuerdo a ella, en el estado de reposo la membrana es solamente
permeable a los iones de potasio. Así, el potencial de reposo de una célula
debe ser igual al potencial de Nernst correspondiente al potasio.
Berstein
comenzaba así sus Investigaciones sobre
la termodinámica del tejido bioeléctrico [Bernstein, 1902]: "Las corrientes
eléctricas observadas en numerosos órganos vivos de animales y plantas han
llegado a ser objeto de múltiples investigaciones. Detectamos esas corrientes
en músculos, nervios, glándulas secretoras y órganos eléctricos de los peces
'tumbadores', así como en tejidos vegetales (…) Tórnase verosímil que todas
estas corrientes tengan un modo similar de generarse, si no el mismo; y que sus
capacidades y potencia dependan de las condiciones estructurales y composición
química de la células que forman cada órgano." [1]
La figura
siguiente, tomada del mencionado trabajo de Bernstein, ilustra su concepción de
esa causa común o modo similar de generarse:
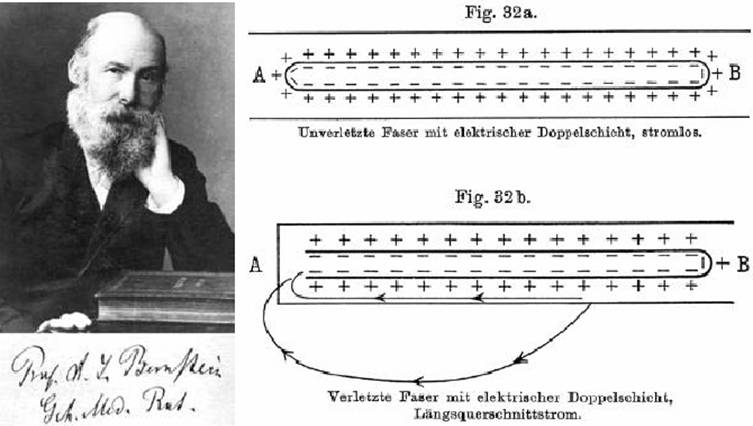
Durante un
potencial de acción, la membrana perdía transitoriamente su permeabilidad selectiva
al potasio; así, el potencial de membrana debía aproximarse a cero, pues el potencial
debía crecer al mismo nivel adentro que afuera de la célula. Pero la primera
medición intracelular del potencial de acción (1939, más arriba) mostró
claramente que este estaba por encima del potencial nulo.
Esto constituyó
una sentencia de muerte para el modelo de Bernstein. No obstante, la concreción
de tal sentencia se hizo esperar un poco. Llama la atención que la posibilidad,
de que el potencial de acción sobrepasase el valor cero (overshoot, sobre-voltaje), hubiera sido ya considerada por muchos
neurofisiólogos, incluyendo al propio Bernstein previamente a la formulación de
su modelo. Sin embargo, todas estas discusiones preliminares estuvieron basadas
en observaciones indirectas. Desde el punto de vista conceptual, no había lugar
para ningún "potencial por encima de cero" en el marco teórico de
Bernstein.
Con los estudios de Bernstein se inició la electrofisiología moderna.
Este autor determinó las bases electroquímicas de los fenómenos bioeléctricos y
desde sus trabajos se ha reconocido el papel fundamental de la concentración
del potasio intracelular en la generación de los potenciales de reposo y de
lesión en músculo y nervio. Bernstein desarrolló su teoría
para explicar los biopotenciales de membrana a consecuencia de la hipótesis de
du Bois-Reymond, quien había postulado la existencia de partículas eléctricas
regularmente ordenadas a lo largo de la superficie del músculo y del nervio.
Bernstein desarrolló su teoría sobre la base de los trabajos de Ostwald y de
Nernst sobre la diferencia de potencial eléctrico entre dos soluciones del
mismo electrolito a dos concentraciones diferentes, separadas por una membrana
selectivamente permeable. El electrolito de mayor movilidad tenderá a avanzar
más rápidamente que los demás. Creará pues un frente eléctrico de su mismo
signo, manifiesto como una diferencia de potencial eléctrico entre las dos
soluciones. La diferencia de potencial generada se puede calcular mediante la
ecuación derivada por Nernst. Una versión simplificada de esta ecuación aparece
en casi todos los textos de fisiología:
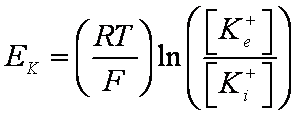 ,
,
donde [K+e] es la concentración extracelular del
potasio y [K+i] su
concentración intracelular; EK es el potencial eléctrico transmembrana, R es la constante de los gases, T la temperatura absoluta y F la constante de Faraday.
Es debido a este estado de cosas que
el trabajo de Hodgkin y Huxley del año 1939 adquirió relevancia. Es el primer
registro detallado de un potencial de acción. A partir de él se determina que
el potencial de acción tiene una magnitud absoluta cercana a unos 90 mV (a
20°C), de lo que se concluye que el
interior celular pasa a ser eléctricamente positivo durante el potencial de
acción.
Hodgkin y Huxley realizaron las
mediciones en el axón gigante de calamar, cuyo carácter axonal había sido demostrado
en el año 1936 por el neuromalacólogo J. Z. Young. Esta fibra – nerviosa, pues
– tiene un diámetro convenientemente grande, cercano al milímetro como dijimos,
lo que consiente mejor manipulación experimental que la mayoría de las células
nerviosas conocidas. El proceso, en suma, es un cambio muy veloz en la
polaridad de la membrana, cambio que va de negativo a positivo y de vuelta a
negativo, en este ciclo que sólo dura algunos milisegundos:
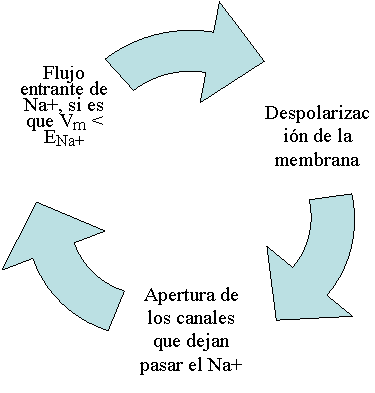
En él, algunos canales iónicos que
atraviesan la membrana se abren y se cierran según el voltaje que establece, en
ese momento, el potencial del campo eléctrico en que están inmersos - cuya intensidad
local depende, como se dijo, de la distribución espacial de las concentraciones
de las cargas iónicas no equilibradas. Tales canales, para abrirse y cerrarse,
deben cambiar de forma. Aunque en realidad tienen formas más complejas, un modo
elemental de figurárselos es así:
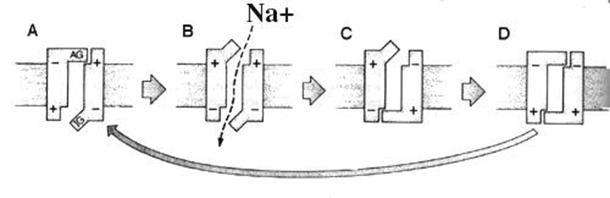
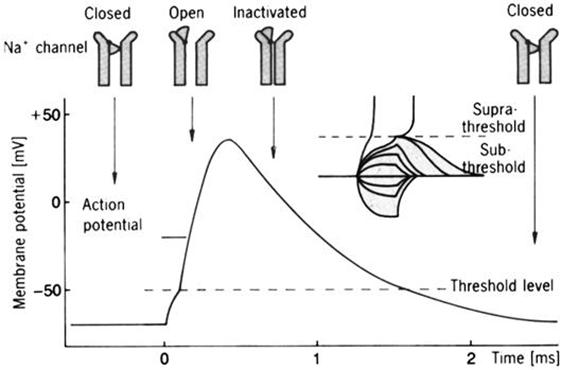
Un sencillo modelo del canal
sensitivo al voltaje para iones de sodio, Na+, mostraría cuatro
posiciones. (A) En reposo, el portal de activación (AG) está cerrado y el de inactivación (IG) abierto. (B) Durante la activación, ambos portales se abren.
(C) En la inactivación, se cierra el portal de inactivación, el de activación
aún permanece abierto. (D). Durante el período refractario, ambos portales están
cerrados. Dibujándolo:
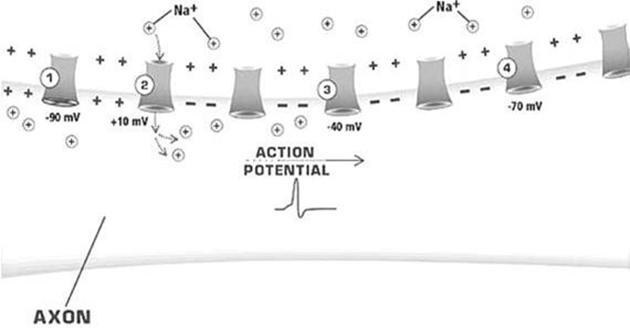
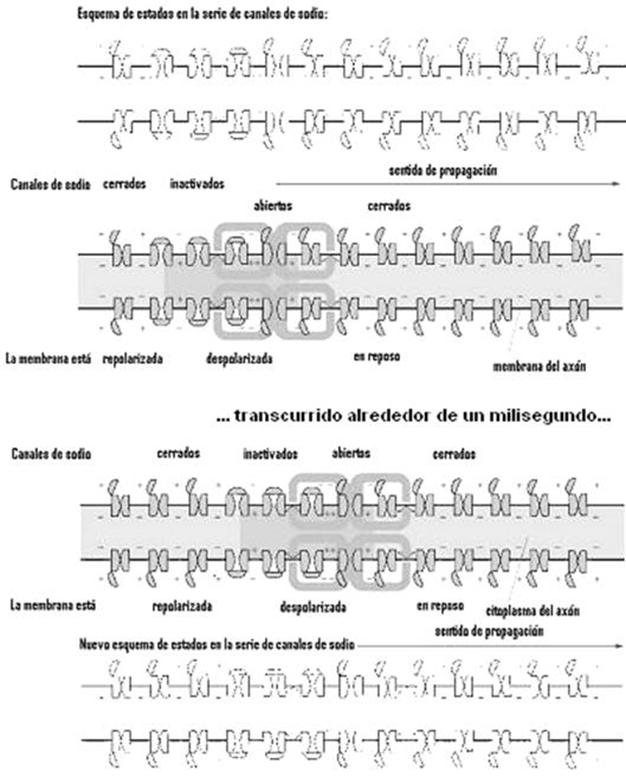
Esto permite figurarse el corte
longitudinal de un axón del modo que sigue, con un potencial de acción (action potential en la figura) moviéndose
hacia la derecha. El potencial de acción no alcanzó aún el punto 4; en este, la
membrana todavía está en reposo. En el punto 3, iones positivos, de sodio, se
están moviendo desde la región adyacente, despolarizando esta zona; los canales
de sodio se están por abrir. El punto 2 está en el máximo del potencial de acción;
los canales de sodio están abiertos y hay un flujo de esos iones entrando al
axón. El potencial de acción ya pasó por el punto 1; allí los canales de sodio
están otra vez inactivados y la membrana está hiperpolarizada.
Recordemos que, por repulsión electrostática,
una vez dentro, los iones positivos impulsan los iones positivos próximos a lo
largo del axón y atraen los iones negativos desde la membrana adyacente. Se generan
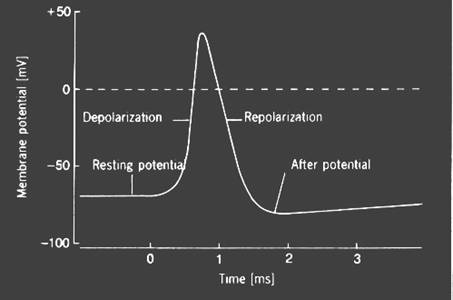
así tres fases del potencial de membrana
– no sólo del potencial de acción, donde estas fases juntas forman el arco
sinusoidal deformado que ya vimos, cuya amplitud depende de las características
de espacio y tiempo transcurrido en la interacción con el electrodo (o
transistor de efecto campo) del aparato registrador. Cada ciclo comprende una fase
ascendente (despolarización), una
fase descendente (repolarización) y
una fase hiperpolarizada. Técnicamente,
la despolarización es cualquier cambio en el potencial de membrana que lleve la
diferencia de potencial a cero. De igual modo, la hiperpolarización es
cualquier cambio de potencial que se aleje de cero. Durante la fase ascendente,
el potencial de membrana primero se aproxima a cero, y luego se hace más
positivo; así, la fase ascendente incluye tanto despolarización como hiperpolarización.
Aunque por ese motivo es técnicamente incorrecto denominar las fases ascendente
y descendente como despolarización e hiperpolarización, esto ha sido sancionado
por el uso y es común observarlo entre físicos así como otros docentes y libros
de neurociencia. Reconociendo
esa costumbre, cabe atenerse a las definiciones siguientes:
Ø
Despolarización es el aumento del potencial de membrana, de -70 mV a
algún potencial positivo (+40 mV marca el máximo de la despolarización en el
potencial de acción).
Ø
Repolarización es el retorno del potencial de membrana al nivel de
reposo – conocido como potencial de reposo.
Ø
Hiperpolarización es lo que acontece en la región de sobrevoltaje
u overshooting del potencial de
acción, cuando el potencial se precipita en una negatividad aun mayor que la
del potencial de reposo.
Ø
En células
especializadas del corazón, como las células del marcapasos coronario, una fase
meseta, de voltaje intermedio, puede aparecer antes de la fase descendente.
Es de comentar en este punto que el
trabajo de Hodgkin y Huxley de 1939 llegó a publicarse apenas pocos días
después del comienzo de la II guerra mundial. El conflicto obligó a realizar un
alto en esas investigaciones para colaborar en el esfuerzo de guerra, retomándolas
al desmilitarizarse sus prioridades. En 1945, propusieron juntos diversas explicaciones
para el sobrevoltaje [Hodgkin & Huxley, 1945], pero resultaron
invalidables. Recién en 1949 Hodgkin y B. Katz [Hodgkin & Katz, 1949]
lograron explicar el sobrevoltaje del potencial de acción por un incremento en
la permeabilidad del sodio, lo cual curiosamente había sido propuesto por E.
Overton ya al nacer el siglo [Overton, 1902].
El propio Huxley reconoce que sus
primeras explicaciones (las presentadas en 1945) estaban del todo equivocadas y
reflexiona [Huxley, 2002; traducción de los autores]: "...si hubiésemos conocido el trabajo de E.
Overton, habríamos podido explicar el sobrevoltaje ya en 1939..." El
mecanismo conduce a un ciclo autoamplificador que, al comienzo de un potencial
de acción, lleva a la rápida apertura de muchos canales de Na+
dependientes del voltaje.
A continuación describiremos, en
forma de sinopsis, los principales supuestos y logros del modelo H-H, sin
profundizar en su análisis. Para más detalles el lector puede consultar el útil
libro de Fisher Weiss [Fisher Weiss, 1997] y el artículo de Clay (2005).
El modelo H-H para el potencial de acción
El modelo H-H se fundamenta en las siguientes
evidencias experimentales disponibles a finales de la década de 1940:
a)
Se había establecido, de manera más o menos firme, que las membranas –
pese a que su estructura se halla mayoritariamente constituída por grasas –
eran selectivamente permeables a diferentes tipos de iones. Se podía describir
al potencial de membrana mediante un circuito equivalente, en el que cada tipo
de ión fluía a través de un canal independiente. La fuerza de arrastre del
n-ésimo ión es la diferencia de potencial electroquímico Vm-Vn,
con Vm el potencial de membrana y Vn el
potencial de Nernst correspondiente al ión n. La facilidad con que un
ión pasa a través de la membrana lipídica está dada por la conductancia Gn.
En reposo, la conductancia del potasio es mucho mayor que la del sodio.
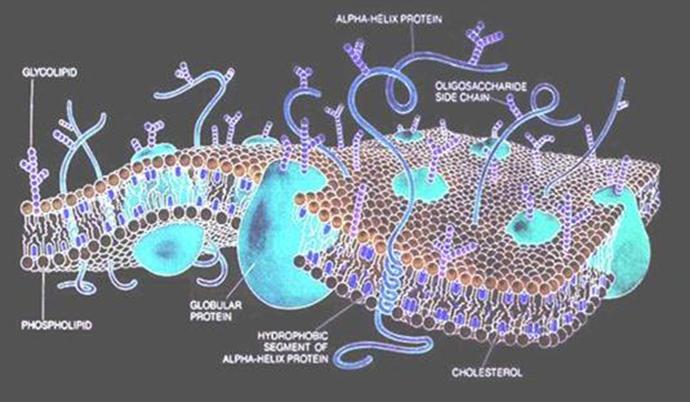
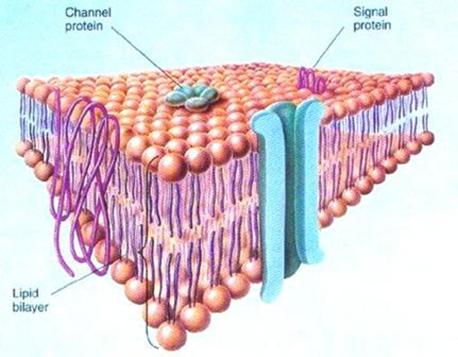
Esquema tridimensional del corte de una membrana
celular, por la artista Dana Burns. El dinámico mosaico fluido está formado por
lípidos y proteinas. La bicapa lipídica forma un andamiaje por donde las
proteínas se difunden libremente. Pueden hallarse componentes glúcidos formando
proteínas (glucoproteínas) o grasas (glucolípidos). Otro importante componente
mostrado es el colesterol, que se intercala entre moléculas lipídicas y afecta
la fluidez y la estabilidad membranales. La estructura cumple funciones
biológicas esenciales, en la respuesta inmune, el metabolismo celular, la neurotransmisión,
la fotosíntesis, la adherencia celular y el crecimiento y diferenciación de las
células. Su detallado conocimiento es crítico para aplicaciones comerciales
vinculadas al seguimiento de las respuestas a drogas, su manufactura química,
los biosensores, las conversiones energéticas y la ingeniería de tejidos.
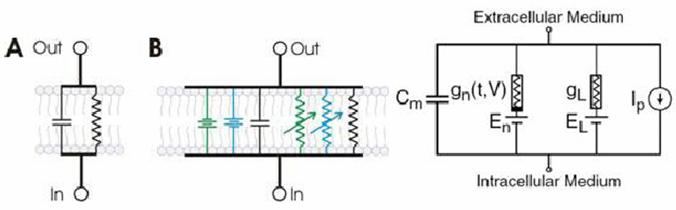
Podemos compararlo con el esquema eléctrico de abajo, con el que se representa
a la membrana en los modelos de tipo HH. En el esquema eléctrico (abajo,
derecha), se representa la bicapa lipídicacomo una capacitancia (Cm).
Los canales de pasage de iones, que se
abren y cierran según el voltage del campo en que están inmersos, están
representados por conductancias no lineares (gn) y lineares (gL), respectivamente.Los gradientes electroquímicos que
impulsan el flujo de iones se representan como baterías (E), y las bombas que bombean e intercambian los iones se
representan como fuentes de corriente (Ip). A la izquierda (A, B) se muestra cómo se articulan estos
elementos. En A, un circuito básico RC (resistencia/condensador) superpuesto
sobre una membrana bicapa, muestra la relación entre ambos. Como se muestra en
B, se pueden utilizar circuitos más elaborados para representar modelos de membranas
con canales iónicos, como este ejemplo con canales de sodio (azul) y potasio
(verde).
b)
Aunque, por entonces, los investigaciones se hallaban muy lejos de poder
visualizar las membranas biológicas en modo similar a la imagen de síntesis
(arriba) dibujada por Dana Burns y hecha famosa en 1985 por la revista Scientific
American (253 [4], pp 86-90, en el artículo The
molecules of the cell membrane por M. S. Bretscher), ya diversas mediciones permitían caracterizar
a la membrana como un circuito formado por una conductancia y una capacidad en
paralelo. Un experimento clave fue el registro de la impedancia durante la ocurrencia
de un potencial de acción. El mismo fue realizado por K. Cole y H. Curtis en
1939 [Cole & Curtis, 1939]. Ambos encontraron que la resistencia de la membrana
caía a un valor bajo durante el potencial de acción, pero la capacidad permanecía
constante.
c)
En 1949, Hodgkin y Katz mostraron que el potencial de acción era
sensible a la concentración de iones de sodio. En particular, un decremento en
la concentración extracelular del sodio reduce el valor pico del potencial de acción.
En experimentos similares, se demostró que cambios pequeños en el potasio
extracelular conducían a cambios relativamente pequeños en el potencial de
reposo y en el pico del potencial de acción.
d)
Pensando así el axón como un circuito eléctrico, Hodgkin y Huxley
sugirieron que el mismo puede tomarse como un conjunto de mallas, como la
mostrada nuevamente en la Figura 3. Tal malla consiste en conductancias variables,
puestas en paralelo, y una capacidad también en paralelo.
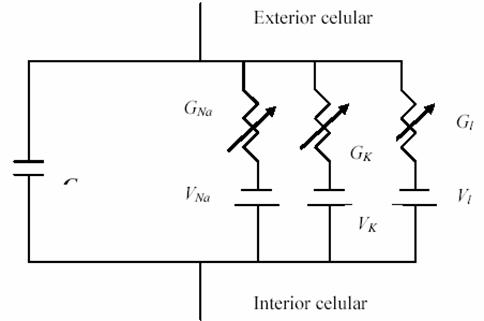
Circuito eléctrico equivalente a un sector de membrana
de axón gigante de Loligo en el modelo
H-H.
Ø
La derivada temporal del potencial a través de tal membrana es
proporcional a la suma de las corrientes en el circuito. Esto se representa
como sigue,
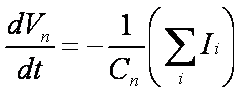
donde Ii denota cada corriente iónica diferente en el modelo.
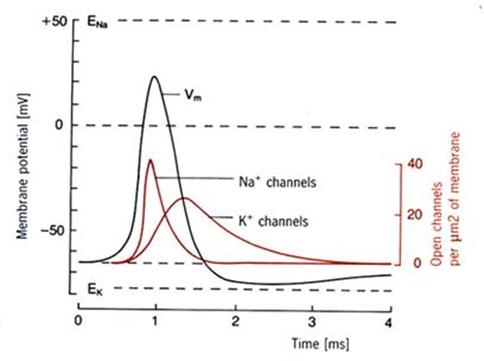
Potencial
de acción generado por dos diferentes
corrientes iónicas, los canales Na+ y K+. Se
muestra la variación del potencial de membrana con el tiempo, así como el
número de canales abiertos por mm2 de superficie de la membrana para
cierta región del axón.
Ø
La técnica experimental que permitió un avance extraordinario en este
campo de investigación fue una ingeniosa técnica experimental, conocida como
"pinza de voltaje" ("voltage clamp"). Se detalla en
todo libro de texto especializado, de modo que no nos extenderemos aquí en su
descripción. Sólo diremos que la misma fue desarrollada por K. Cole [Cole,
1949] y permite medir selectivamente la corriente de cada uno de los tipos de
iones (Na y K) que forman la corriente total a través de la membrana celular.
Tanto Cole como Hodgkin habían reconocido rápidamente que el carácter
"explosivo" del potencial de acción dificultaría el estudio
experimental de la relación corriente-voltaje durante su ocurrencia. Fue el
desafío de superar tal dificultad lo que les exigió desarrollar este instrumento.
Las
ecuaciones
La conducción del
potencial de acción en un axón está gobernada por la ecuación diferencial
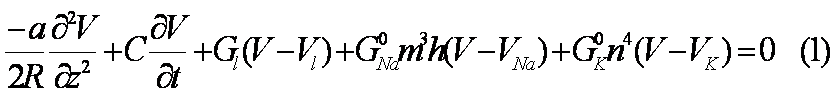 ,
,
en donde C es la capacidad
por unidad de área del axón (de radio a y resistividad axoplasmática R).
Las funciones m, h y n, son dependientes del tiempo y del valor
del potencial de membrana, y están relacionadas con las conductancias del Na y
del K por medio de las expresiones:
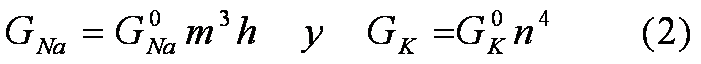 .
.
A su vez, Hodgkin y Huxley modelaron la dinámica
de las funciones n, h y m, por medio de las ecuaciones:
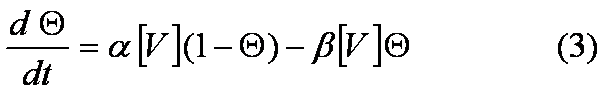 ,
,
en donde Q representa a cualquiera de las
funciones n, h o m, y los coeficientes a y b (dependientes del valor del
potencial de membrana) son distintos para cada una de esas funciones. Es
interesante destacar que Hodgkin y Huxley llegaron a esta dinámica por un cuidadoso
análisis del comportamiento de las conductancias para los iones sodio y
potasio, lo que fue posible gracias al desarrollo de la técnica de la pinza de
voltaje.
Desde un punto de vista matemático el
sistema de ecuaciones (1-3) constituye un sistema de ecuaciones diferenciales
en derivadas parciales, acopladas, no lineales, dependientes del espacio y del
tiempo. En 1952, Hodgkin y Huxley [1952] realizaron una integración del sistema
(1-3), logrando de manera destacada reproducir las principales características
observadas para el potencial de acción. A modo de ejemplo indicamos que, por
este procedimiento de integración, la velocidad de propagación del impulso
nervioso hallado por HH fue 18,8 ms-1, que en el axón real es de ~21
ms‑1. Pero otras características no se modelaban tan bien. A
pesar de los éxitos en la predicción del ritmo y las características cualitativas
del potencial de acción, resultaba imposible predecir ciertas características
esenciales tales como la adaptación y la derivación eléctrica. El modelo
original de Hodgkin y Huxley empleaba únicamente dos corrientes sensibles al
voltaje: el sodio de acción rápida y el potasio de rectificación interna. Hoy
en día los científicos creen que existe una gama mayor de corrientes sensibles
al voltaje, y que las implicaciones de las dinámicas diferenciales, las
modulaciones y la sensibilidad de estas corrientes son importantes para el
ajuste de los modelos que procuran descripciones tanto funcional como biológicamente
realistas de neuronas (y sistemas neuronales), su fisiología y su dinámica.
Estos modelos captan las características esenciales del sistema biológico
en múltiples escalas espacio-temporales, desde las corrientes de membranas, proteínas
y acoplamiento químico hasta las oscilaciones de redes, la arquitectura topográfica
y de columnas neuronales, y el aprendizaje automático y estadístico. Tales
modelos son ante todo computacionales. Los mismos se emplean para confrontar
aquellas hipótesis derivadas que sean directamente verificables mediante experimentos
biológicos, realizables en la actualidad actuales o bien futuros. Se dispone de
una variedad de programas, como el GENESIS
o el NEURON, que permiten in
silico un modelado sistemático y veloz de neuronas que, para ciertos aspectos
relevantes, resultan realistas. Blue Brain, una colaboración entre IBM y
la Escuela Politécnica Federal de Lausana (Suiza), pretende construir, en el
superordenador Blue Gene, una simulación biofísica detallada de una columna
cortical cerebral.
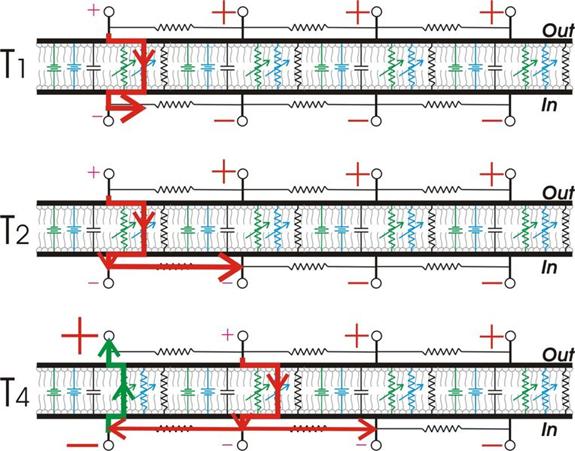
Los potenciales de acción en
propagación pueden ser modelados combinando varios circuitos RC, cada uno de
los cuales representa un anillo de membrana. Este diagrama en tres partes, que
emplea como guía el modelo eléctrico de la membrana, muestra cómo un potencial
de acción se propaga por esta. Una despolarización local abre canales de sodio
locales. La corriente eléctrica consistente en el flujo de sodio causa la
despolarización (T1) de la membrana, que se expande hacia sectores membranales
adyacentes, despolarizándolos también (T2). Así los canales de sodio en este sector
adyacente también se abren, y la despolarización se propaga a lo largo (T4). En
tanto, la corriente retardada rectificadora de iones potasio fluye en el anillo
o sector original de la membrane, causando la fase descendente del potencial de
acción. No se muestra T3, pero puede imaginárselo por interpolation. En T4, la
despolarización se propaga en ambas direcciones de la membrana: también hacia
donde el potencial de acción se había originado. Esto no origina un segundo
potencial de acción porque allí la membrana se ha tornado refractaria, lo que
permite la conducción en una dirección sola.
El origen del umbral del potencial de acción puede visualizarse en la
curva de intensidad contra voltaje (I/V). Esta representa las corrientes
iónicas a través de los canales, frente al potencial de membrana. La curva I/V
de la imagen siguiente es una relación instantánea entre corrientes. Se muestra
el pico de corrientes a determinado voltaje, registrado antes de que ocurra
ninguna inactivación (1 ms tras alcanzar ese voltaje para el sodio). También es
importante comentar que la mayoría de voltajes positivos del gráfico sólo pueden
conseguirse por medios artificiales, mediante la aplicación de electrodos a las
membranas.
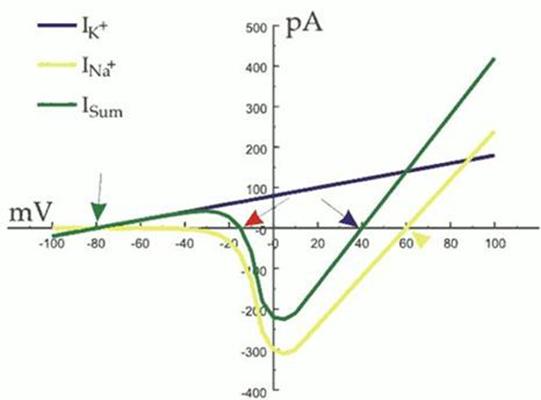
Gráfica de
corrientes (flujo iónico) frente a voltaje (potencial de membrana), ilustrando
el umbral (flecha roja) del potencial de acción de una célula ideal.
En la curva I/V se destacan cuatro puntos, indicados por las flechas
de la figura:
1.
La flecha verde indica el
potencial de reposo de la célula y el valor del potencial de equilibrio para el
potasio (Ek). Debido a que el canal K+ es el único
abierto con esos valores de voltaje negativos, la célula se mantendrá en Ek.
Aparecerá un potencial de reposo estable con cualquier voltaje en que la sumatoria
I/V (línea verde) cruce el punto de corriente nula (eje x) con una pendiente
positiva, como lo hace en la flecha verde. Esto se debe a que cualquier perturbación
del potencial de membrana hacia valores negativos significará corrientes netas
de entrada que despolarizarán la célula más allá del punto de cruce, mientras
que cualquier perturbación hacia valores positivos significará corrientes netas
de salida que hiperpolarizarán la célula. Así, cualquier cambio del potencial de membrana de pendiente positiva tiende
a devolver a la célula al valor de cruce con el eje.
2.
La flecha amarilla indica el equilibrio del potencial Na+
(ENa). En este sistema de dos iones, el ENa es el límite
natural del potencial de membrana del que la célula no puede pasar. Los valores
de corrientes en el gráfico que exceden este límite se han medido de forma artificial,
obligando a la célula a sobrepasarlo. Aún así, el ENa sólo podría
alcanzarse si la corriente de potasio no existiese.
3.
La flecha azul indica el voltaje máximo que puede alcanzar el
pico del potencial de acción. Es el potencial de membrana máximo que puede alcanzar
la célula en estado natural, y no puede llegar al ENa debido a la acción
contraria de los flujos de potasio.
4.
La flecha roja indica el umbral del potencial de acción. Es el
punto donde el Isum se cambia a un flujo neto hacia el interior.
Destaca que en este punto se atraviesa el punto de flujo neto cero, pero con
pendiente negativa. Cualquier "punto de corte con pendiente negativa"
del nivel de flujo cero en el gráfico I/V es un punto inestable. Si el voltaje
en este punto es negativo, el flujo va hacia el exterior y la célula tiende a
volver al potencial de reposo. Si el voltaje es positivo, el flujo va hacia el
interior y tiende a despolarizar la célula. Esta despolarización implica mayor
flujo hacia el interior, haciendo que los flujos de sodio se realimenten. El punto
en el que la línea verde alcanza el valor más negativo es cuando todos los canales
de sodio están abiertos. La despolarización más allá de este punto baja las
corrientes de sodio ya que la fuerza eléctrica disminuye a medida que el
potencial de membrana se acerca a ENa.
El umbral del potencial de
acción se confunde a veces con el umbral de la apertura de canales de sodio. Eso es incorrecto, ya que los
canales de sodio carecen de umbral. Se abren aleatoriamente, en respuesta a la
despolarización. La despolarización no implica tanto la apertura de los canales
como el incremento de la probabilidad de que se abran. Incluso en potenciales de hiperpolarización, algún canal de sodio puede
abrirse esporádicamente. Además, el umbral del potencial de acción no es el
voltaje ante el cual el flujo de iones sodio se hace importante; es el punto en
que excede el flujo de potasio.
Biológicamente, en las neuronas la despolarización se origina en las
sinapsis dendríticas (la siguiente es una representación artística de dos de
ellas, en una espina dendrítica bifurcada; la dendrita de la que emerge la espina
aparece abajo, a la izquierda), aunque, en principio, los potenciales de acción
podrían generarse en cualquier punto a lo largo de la fibra nerviosa.
Los potenciales de acción se propagan más rápido en axones de mayor
diámetro, a igualdad de los otros parámetros. La principal razón es que la
resistencia axial de la luz del axón se hace menor cuanto mayor sea el diámetro,
debido a la mayor proporción de superficie de membrana respecto a la superficie
de cada corte transversal. En otras palabras: con la misma fuerza de repulsión
electrostática, los axones más gruesos tienen más membrana para difundir iones.
Como la superficie de la membrana es el obstáculo principal para propagar el
potencial en axones amielínicos, el incremento de esta proporción es una forma
efectiva de incrementar la velocidad de transmisión. Un ejemplo notable de animal
que utiliza el aumento de diámetro del axón como regulador de la velocidad de
propagación del potencial de membrana, es el calamar. El axón del Loligo, que puede sobrepasar el diámetro
neuronalmente gigantesco de un milímetro, controla la contracción muscular que
permite al animal su respuesta de evasión de los depredadores. Es una
adaptación para permitir una activación muy rápida del mecanismo de escape. La
velocidad de los impulsos nerviosos directamente conducidos por estas fibras es
una de las más rápidas de la biósfera, cuyo valor ya mencionado ronda los ~21
ms‑1 (~75 km/h).
Adaptaciones
morfológicas
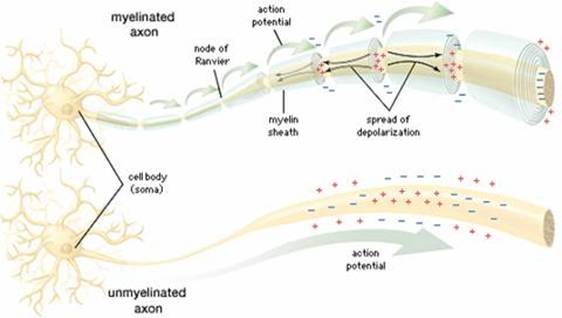
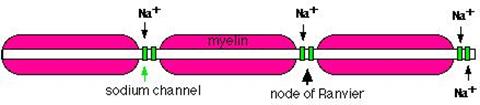
En cambio, los axones mielínicos emplean la conducción saltatoria. Los
potenciales de acción parecen saltar a lo largo del axón, siendo regenerados
sólo en unos anillos donde el axón no está aislado: los nódulos de Ranvier.
La conducción saltatoria aumenta la velocidad de conducción nerviosa
sin tener que incrementar significativamente el diámetro del axón. Sin conducción saltatoria, una alta velocidad
de conducción requeriría incrementos drásticos en el diámetro del axón, que podrían
exigir la formación de sistemas nerviosos desproporcionadamente grandes para
los cuerpos que han de asistir. El principal obstáculo para la velocidad de
transmisión en axones amielínicos es la capacitancia de la membrana. Sabemos
que la capacidad de un condensador puede disminuirse bajando el área de un
corte transversal de sus placas, o incrementando la distancia entre las placas.
El sistema nervioso, para reducir la capacitancia de la membrana, utiliza la mielinización.
Separa las placas insertando una vaina protectora, la mielina. Esta es creada
alrededor de los axones por las células de Schwann y los oligodendrocitos, células
de la neuroglía que aplastan sus citoplasmas formando láminas de membrana y
plasma. Tales láminas se arrollan al axón, alejando entre sí las "placas"
conductoras (el plasma intra y extracelular), y disminuyen la capacitancia de
la membrana: la presencia de mielina aumenta Rm y disminuye Cm .
Por eso, si se inyecta la misma cantidad de corriente en axones mielinizados y amielínicos,
el voltaje que se desarrolla a través de la membrana del axón mielinizado es
mayor, debido al aumento de Rm . Además, la constante de tiempo
(tau, t = RC) de la membrana se abrevia respecto
a Rm debido a la disminución de Cm . Así, en la fibra
mielinizada, el potencial de acción también se genera más rápido. El aislamiento
resultante redunda pues en una conducción muy veloz, mediada por el potencial
electrostático a través de las secciones mielinizadas del axón; pero impide
generar potenciales de acción en estos segmentos. Los potenciales de acción
sólo se vuelven a producir en los nódulos de Ranvier, anillos desmielinizados
que se sitúan entre los segmentos mielinizados. En estos anillos hay gran número
de canales de sodio dependientes de voltaje (su densidad supera en hasta cuatro
órdenes de magnitud la de axones amielínicos), que permiten que los potenciales
de acción se regeneren de forma eficaz en ellos. Debido a la mielinización, los
segmentos aislados del axón actúan como un cable pasivo: conducen los potenciales
de acción rápidamente porque la capacitancia de la membrana es muy baja, y minimizan
la degradación de los potenciales de acción porque la resistencia de la membrana
es alta. Cuando esta señal que se propaga de forma pasiva alcanza un nodo de Ranvier,
inicia un potencial de acción. Este viaja de nuevo de forma pasiva hasta que
alcanza el siguiente nodo, repitiendo el ciclo.
La longitud de
los segmentos mielinizados de un axón es importante para la conducción saltatoria.
Deben ser lo más largos que sea posible, para optimizar la distancia de la conducción
pasiva, pero no tan largos como para provocar que la disminución, en la intensidad
de la señal pasivamente propagada, no permita alcanzar el umbral del potencial
de acción en el siguiente nodo de Ranvier. En realidad, los segmentos mielinizados
son suficientemente largos para que la señal que se propaga pasivamente recorra
al menos dos segmentos mientras aún mantiene bastante amplitud de señal para
iniciar un potencial de acción en el segundo o tercer nodo. Así se eleva el
factor de seguridad de la conducción saltatoria, permitiendo que la transmisión
traspase nodos en caso de que estén dañados.
Conclusiones
Inmediatamente
después de su publicación, el modelo H-H fue reconocido como un avance crucial
para el entendimiento de la excitación nerviosa. El modelo no sólo introduce el
concepto revolucionario de corrientes separadas, portadas por diferentes iones
y por ende con diferentes comportamientos, sino también establece un modo de
análisis considerado definitivo para la descripción de cualquier corriente
iónica a través de las membranas celulares. Desde el punto de vista histórico,
en lo referido al desarrollo del modelo, se observan nítidamente tres etapas:
la identificación de las especies iónicas que portan la corriente; la obtención
de las curvas de activación y desactivación (conductancias) de las corrientes,
y finalmente la medición de la cinética del flujo iónico.
En este contexto,
una de las conclusiones más sobresalientes del modelo H-H es que el impulso nervioso
consiste en un rápido y coordinado flujo entrante y saliente de iones potasio y
de iones sodio. Sin embargo el modelo no proponía ningún mecanismo específico
para la variación de las conductividades de los distintos iones a través de la
membrana celular. Al respecto, en un trabajo de suma importancia, Hodgkin y
Keynes sugieren que
"los iones cruzan la membrana a través de cadenas de cargas negativas o
a través de tubos delgados o canales... en los cuales los ellos están
restringidos a moverse en una única fila [con] varios iones al mismo tiempo" [Hodgkin y Keynes,1955].
Junto a esta
sugerencia, y precisamente sobre la base de las evidencias logradas durante el
desarrollo del modelo H-H, fueron capaces de identificar las características
básicas que esos canales deberían tener: por un lado, ser selectivos, es decir,
previeron que debería haber canales específicos para el Na y otros para el K; y
además, que deberían poder activarse en una fracción de milisegundo por cambios
en el potencial de membrana. Pasaron más de veinte años antes de que la idea de
la existencia de los canales iónicos fuese plenamente aceptada [Hille et al., 1999]. La prueba final de la
existencia de los canales estuvo fundamentada en las mediciones realizadas por
Neher y Sakman sobre un único canal [Hamill et al., 1981].
Modelos moleculares que exhiben
diversos aspectos de la complejidad de un canal iónico.
Aunque las
técnicas de registro en un único canal iónico y las mediciones precisas de la activación
de los canales han mostrado que, desde un punto de vista conceptual, el modelo
de puertas independientes sugerido por H-H es incorrecto, su modelización matemática,
tanto en su versión original, como en algunas versiones más simples [FitzHugh,
1961], sigue siendo utilizada para la descripción del fenómeno de excitación
nerviosa en una escala macroscópica (es decir, a un nivel de una célula entera
y no de un único canal) [Chik et al.,
2001; Schmid et al., 2001].
Dada la brevedad de este trabajo, nos hemos concentrado en lo que
consideramos los aspectos más relevantes del modelo y del proceso que llevó a
su desarrollo. Una descripción detallada de cada paso obligaría a un tratamiento
significativamente más extenso. Hemos realizado ese abordaje minucioso y lo que
exponemos aquí es sólo una síntesis. Nuestra mayor motivación para estudiarlo
con bastante detalle ha sido el maravilloso equilibrio que refleja entre aspectos
matemáticos, conceptuales y experimentales, con destacados aciertos en cada uno
de estos dominios.
Asimismo, plantea aún importantísimas
cuestiones pendientes. Desde 1906, cuatro años después que Bernstein proclamara
como verosímil que todas las
corrientes bioeléctricas tuvieran un modo similar de generarse y que sus capacidades
y potencia dependiesen de las condiciones estructurales y composición química
de la células que forman cada órgano; y también cuatro años después que Overton propusiera explicar el sobrevoltaje del potencial de acción
por un incremento en la permeabilidad del sodio, Christofredo Jakob [1906,
1907, 1908], en la tradición académica conocida como escuela neurobiológica
argentino-germana, comenzó a desarrollar modelos de la integración de esos potenciales en el volumen del tejido gris
cerebral, donde cada neurona recibe potenciales de miles de otras. Jakob, neuroanatomista y músico,
legó a su escuela la concepción de una anatomía espaciotemporal, donde la diferencia
entre un parpadeo y una costilla es sólo de escala, no intrínseca. Propuso pues
la formación de un sistema de ondas estacionarias por integración de ébranlements o neuroactividad total en
el volumen de la corteza cerebral, excluyendo el efecto de la actividad en las
fibras mielinizadas. Pero los elementos de ese sistema, las ondas estacionarias
à la Helmhotz, no eran el nivel más
superior de integración "neuroanatómica". Su movilidad los llevaba a
interferir, constituyendo un correlograma que establecía figuras de moire, como las definidas en lo que
desde seis décadas después llamamos hologramas y holofonos. Esas figuras de moire son, a su vez, los elementos con
relevancia psicológica del estado dieléctrico instantáneo del volumen de tejido
cortical. Va sin decir que esos movilísimos elementos del sistema de integración
de todos los potenciales nerviosos, axonales y dendríticos, derivados de las efímeras
ondas estacionarias constituídas en el nivel integrativo inmediato inferior,
excedían a la capacidad de modelación detallada de la electroneurobiología, no
sólo de su época sino la de la nuestra. Quizás la presente reseña tiente a
algun@ de nuestros estudios@s a proseguir esta línea de trabajo, que aún tiene
tanto que ofrecer. Entendemos que el tratamiento
integrado de tipo histórico del tema contribuye a una comprensión mucho más
adecuada del lugar fundamental que tuvo y tiene el modelo H-H en las disciplinas
vinculadas a las neurociencias, a la vez que refleja su estado de desarrollo
altamente sofisticado, en el que los modelos cualitativos de corte naturalista
van dejando lugar a versiones de considerable madurez matemática y experimental.

Andrew Huxley en el Trinity
College, Cambridge, julio de 2005
Bibliografía
Bernstein, J.
(1902), Untersuchungen zur Thermodynamik
der bioelektrischen Ströme [Investigaciones sobre la termodinámica del
tejido bioeléctrico]. Pflügers Archiv ges. Physiol. 92, pag. 521-562.
Bernstein, J. (1912): Elektrobiologie. Die
Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage
dargestellt. [Electrobiología – la ciencia de los
procesos eléctricos en el organismo, expuesta en base a sus fundamentos
actuales]. Braunschweig:
Vieweg und Sohn.
Chik, D. T. W.,
Wang, Y. y Wang, Z. D. (2001), Stochastic resonance in a Hodgkin-Huxley neuron
in the absence of external noise. Z. Phys. Rev. D, 64, 021913.
Clay J. R.
(2005). Axonal excitability revisited. Prog Biophys Mol Biol. 88 (1),
59-90, May.
Cole, K. S. y
Curtis, H. (1939), Electric
impedance of the squid giant axon during activity, J. of
General Physiology, 22, 649-670.
Cole, K. S.
(1949), Dynamic electrical characteristics of the squid axon membrane, Archives des Sciences Physiologiques 3, 253-258.
Du Bois-Reymond, E.
(1843), Vorlaufiger
abriss einer untersuchung uber den sogenannten frochstrom und uber die
elektro-motorischen fische [Sumario actual de una
investigación sobre la llamada corriente de los anfibios y los peces electromotores]. Poggendorffs
Annalen der Physik und Chemie 58: 1-30.
Du Bois-Reymond,
E. (1848-1849), Untersuchungen über
thierische Elektricität [Investigaciones sobre electricidad animal], G.E.
Reimer Vlg., Berlin.
Fisher Weiss, T.
(1997), Cellular Biophysics, Vol 2, The MIT Press, Massachusetts.
FitzHugh, R. A. (1961), Impulses
and physiological states in theoretical models of nerve membrane, Biophys. J.
1, 445-466.
Hamill, O. P., Marty, A., Neher,
E., Sakmann, F. y Sigworth, F. J. (1981), Improved patch clamp techniques for
high-resolution current recording from cells and cell-free membrane patches, Pfluger
Archiv: European Journal of Physiology 391 (2), 85-100.
Helmholtz, H. von. (1852), Messungen über
Fortpflanzugsgeschwindigkeit der Reizung in Nerven [Mediciones de la velocidad de propagación del
estímulo en los nervios], Arch. Anat. Physiol. Wiss. Medizin. 199-216
Helmholtz, H. von (1889), Popular
Scientific Lectures, Longmans, London.
Hille, B., Armstrong, C. M. y
MacKinnon, R. (1999), Ion channels: From idea to reality, Nature Medicine 5 (10) 1105 – 1109.
Hodgkin, A. L. y Huxley, A. F. (1939), Action potentials
recorded from inside a nerve fibre, Nature 144 (1939), 710-711
[primer registro publicado de un potencial de acción].
Hodgkin, A. L. y Huxley, A. F. (1945), Resting and action
potentials in single nerve fibres,
J. Physiology, 104, 176-195. [Agrega detalles e hipótesis tentativas, luego
reveladas erróneas, al trabajo anterior].
Hodgkin, A. L. y Katz, B. (1949), The effect of sodium
ions on the electrical activity of the giant axon of the squid, J. Physiology, 108,
37-77.
Hodgkin, A. L. y Huxley, A. F. (1952a), Currents carried
by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiology 116 (4), 449-472, Apr.
Hodgkin, A. L. y Huxley, A. F. (1952b), The components of
membrane conductance in the giant axon of Loligo.
J. Physiology 116 (4), 473-496, Apr.
Hodgkin, A. L. y Huxley, A. F. (1952c), The dual effect of
membrane potential on sodium conductance in the giant axon of Loligo. J. Physiology 116 (4), 497-506; April.
Hodgkin, A. L. y Huxley, A. F. (1952d), A quantitative description
of membrane current and its application to conduction and excitation in nerve. J.
Physiology, 117 (4),
500-544; Aug.
Hodgkin, A. L. y Keynes, R. D. (1955), The potassium permeability
of a giant nerve fibre, J. Physiology, 128, 61-88.
Huxley, A. F. (2002), Hodgkin
and the action potential, 1935-1952, J. Physiol., 538 (1), 2.
Jakob, Christfried (1906, 1907, 1908),
“Localización del alma y de la inteligencia,” El Libro (Buenos Aires) 1
(1906), 151; y (1907), pp. 281, 433, 553; V. 2 (1908) pp. 3, 171, 293, 537 y 695 (publicado en nueve nros).
Matteucci, C. (1842), Sur un phenomene physiologique
produit par les muscles en contraction, Ann.
Chim. Phys. 6, 339-341.
Matteucci, C. (1844), Traité
des phénoménes electro-physiologiques des animaux, suivi d'études anatomiques
sur le systéme nerveux et sur l'organe electrique de la torpille. Fortin et
Masson, Paris.
Nernst, W. (1888), Zur Kinetik der
losung befindlichen Körper [Sobre la
cinética de las substancias disueltas] y Theorie
der Diffusion [Teoría de la difusión], Z. Physik Chem. 2, 613-622 y 634-637.
Overton, E. (1902), Beiträge zur allgemeinen Muskel- und Nervenphysiologie.
II. Mittheilung. Ueber die Unentbehrlichkeit von Natrium- (oder Litium-) Ionen
für den Contractionsact des Muskels [Ensayo sobre fisiología general de
músculos y nervios, 2da. Parte: Acerca de la indispensabilidad de los iones de
sodio (o de litio) para el acto de contracción muscular], Pflügers Archiv ges. Physiol. 92,
346-386.
Schmid, G., Goychuk, I. y Hänggi, P
(2001), Stochastic resonance as a collective property of ion channel assemblies,
Europhys. Lett. 56 (1), 22-28, arXiv: physics/0106036
Verkhratsky, A., Krishtal, O. A. y Petersen, O.
H.(2006), From Galvani to patch clamp: the development of electrophysiology, Pflügers
Archiv - European Journal of Physiology 453 (3), 233-247
Young J. Z. (1936), The structure of nerve fibres in cephalopods
and crustacea, Proc Roy Soc London B 121: 319-336.
En Internet:
The Hodgkin-Huxley Model, one
cell - Interactive Java applet of the HH
model. Simulador virtual, en que los parámetros del modelo y de
la excitación pueden variarse y es posible graficar todas las variables en un
espacio de fase. URL: http://thevirtualheart.org/HHindex.html
Simulador de ecuaciones
Nernst/Goldman http://www.nernstgoldman.physiology.arizona.edu/
La ecuación de Nerst y los
potenciales de acción en el sistema nervioso, http://www.medicalcomputing.net/action_potentials.html

Copyright © September 2007 Electroneurobiología. Diese Forschungsarbeit ist öffentlich zugänglich. Die treue
Reproduktion und die Verbreitung durch Medien ist nur unter folgenden Bedingungen
gestattet: Wiedergabe dieses Absatzes sowie Angabe der kompletten Referenz bei
Veröffentlichung, inklusive der originalen Internetadresse (URL, siehe oben). /
Este texto es un artículo de acceso público; su copia exacta y redistribución
por cualquier medio están permitidas bajo la condición de conservar esta
noticia y la referencia completa a su publicación incluyendo la URL (ver
arriba). / This is an Open Access article: verbatim copying and redistribution
of this article are permitted in all media for any purpose, provided this
notice is preserved along with the article's full citation and URL (above).
Accepted and published: September 28, 2007

revista
Electroneurobiología
ISSN: 0328-0446